Nadmiarowy potencjał termodynamiczny (nadmiarowa entalpia swobodna, nadmiarowa
energia swobodna Gibbsa) 1 mola roztworu
wynosi:

a po podstawieniu wyrażeń na współczynniki aktywności zgodnie z równaniami EHL i przekształceniu otrzymujemy wzór na potencjał termodynamiczny mieszania 1 mola roztworu B w A:
![Gm/(R·T) = GEm/(R·T)+xA·ln(xA)+xB·ln(xB) = xB·ln[xB/(xB+RBA·xA)]+RBA·xA·ln[RBA·xA/(xB+RBA·xA)]+(1-RBA)·xA·ln(1)+ln(QBA)·xB+[ln(KA)/RBA]·RBA·xA, gdzie: Gm = potencjał termodynamiczny mieszania 1 mola roztworu B w A.](grafika/wzory4.png)
Powyższy wzór można otrzymać przy założeniu układu złożonego:
- z mieszaniny substancji rozpuszczonej i ustalonej części rozpuszczalnika oraz
- z pozostałej ilości rozpuszczalnika w stanie czystym (niezmienionym).
Dwa ostatnie składniki powyższego równania wynikają ze zmiany wartości molowych potencjałów termodynamicznych składników w takim stanie, w jakim są w roztworze, w porównaniu z wartościami dla czystych składników (konsekwencja przyjęcia czystej substancji za stan standardowy). Przyjmuję, że zmiany strukturalne (a więc i potencjału termodynamicznego) dotyczą tylko rozpuszczalnika związanego z substancją rozpuszczoną. Te zmiany związane są ściśle z zachowaniem się w zakresie dużego rozcieńczenia, w którym obowiązuje prawo Henry'ego. W tym zakresie substancji rozpuszczonej jest zbyt mało i nie jest ona w stanie wpływać na strukturę rozpuszczalnika, którego współczynnik aktywności jest w związku z tym równy 1 (współczynnik aktywności substancji rozpuszczonej jest stały). Przykładami mogą być układy metanol-woda i etanol-woda, które przy 760 mm Hg spełniają prawo Henry'ego do ułamka molowego alkoholu równego około 0,005 (Per Dalager, J. Chem. Eng. Data 14 (3), 298, 1969).
Poniżej przedstawiam schematyczny wykres zależności odwrotności współczynników aktywności od ułamka molowego w układzie dwuskładnikowym, zgodny z równaniami EHL (zakresy odpowiadające prawu Henry'ego są oczywiście zbyt duże).
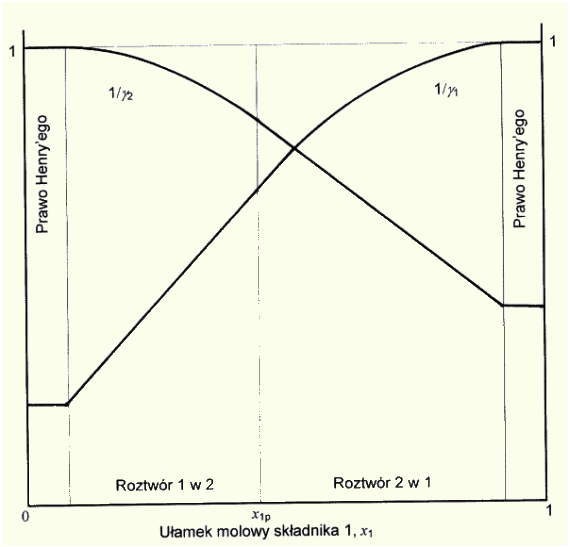
Konsekwencją powyższych rozważań jest ogólny wniosek, że niezależnie od stosowanego równania do dokładnego opisu współczynników aktywności w układzie dwuskładnikowym trzeba co najmniej czterech parametrów - co najmniej dwa do opisu niesymetrycznej krzywej (w zakresie nie odpowiadającym prawu Henry'ego) i dokładnie dwa do uwzględnienia zmian strukturalnych składników mieszaniny.

a po podstawieniu wyrażeń na współczynniki aktywności zgodnie z równaniami EHL i przekształceniu otrzymujemy wzór na potencjał termodynamiczny mieszania 1 mola roztworu B w A:
![Gm/(R·T) = GEm/(R·T)+xA·ln(xA)+xB·ln(xB) = xB·ln[xB/(xB+RBA·xA)]+RBA·xA·ln[RBA·xA/(xB+RBA·xA)]+(1-RBA)·xA·ln(1)+ln(QBA)·xB+[ln(KA)/RBA]·RBA·xA, gdzie: Gm = potencjał termodynamiczny mieszania 1 mola roztworu B w A.](grafika/wzory4.png)
Powyższy wzór można otrzymać przy założeniu układu złożonego:
- z mieszaniny substancji rozpuszczonej i ustalonej części rozpuszczalnika oraz
- z pozostałej ilości rozpuszczalnika w stanie czystym (niezmienionym).
Dwa ostatnie składniki powyższego równania wynikają ze zmiany wartości molowych potencjałów termodynamicznych składników w takim stanie, w jakim są w roztworze, w porównaniu z wartościami dla czystych składników (konsekwencja przyjęcia czystej substancji za stan standardowy). Przyjmuję, że zmiany strukturalne (a więc i potencjału termodynamicznego) dotyczą tylko rozpuszczalnika związanego z substancją rozpuszczoną. Te zmiany związane są ściśle z zachowaniem się w zakresie dużego rozcieńczenia, w którym obowiązuje prawo Henry'ego. W tym zakresie substancji rozpuszczonej jest zbyt mało i nie jest ona w stanie wpływać na strukturę rozpuszczalnika, którego współczynnik aktywności jest w związku z tym równy 1 (współczynnik aktywności substancji rozpuszczonej jest stały). Przykładami mogą być układy metanol-woda i etanol-woda, które przy 760 mm Hg spełniają prawo Henry'ego do ułamka molowego alkoholu równego około 0,005 (Per Dalager, J. Chem. Eng. Data 14 (3), 298, 1969).
Poniżej przedstawiam schematyczny wykres zależności odwrotności współczynników aktywności od ułamka molowego w układzie dwuskładnikowym, zgodny z równaniami EHL (zakresy odpowiadające prawu Henry'ego są oczywiście zbyt duże).

Konsekwencją powyższych rozważań jest ogólny wniosek, że niezależnie od stosowanego równania do dokładnego opisu współczynników aktywności w układzie dwuskładnikowym trzeba co najmniej czterech parametrów - co najmniej dwa do opisu niesymetrycznej krzywej (w zakresie nie odpowiadającym prawu Henry'ego) i dokładnie dwa do uwzględnienia zmian strukturalnych składników mieszaniny.
- Dalej: Próba opisu
Skok do: Góra strony